在厌氧消化(AD)过程中,监测微生物挥发性有机化合物(mVOCs)的产生可作为评估微生物群落稳定性的潜在指标。传统操作参数(如pH、挥发性脂肪酸等)常滞后于微生物的实际性能表现,而本研究提出以mVOCs作为新型指标,反映微生物的种属特异性特征,并评估其对有机负荷率(OLR)扰动下AD过程稳定性指示能力。实验中,无论是逐渐增加还是脉冲式增加OLR浓度,均导致mVOCs产量的瞬时变化,其中烷烃、烯烃、醇类、醛类、酮类和芳香烃类化合物对OLR扰动的响应更为显著。此外,这些mVOCs与特定细菌属(如互营单胞菌属(Syntrophomonas)、脱流热袍菌属(Defluviitoga)和苛求丝菌属(Fastidiosipila))以及古菌属(如甲烷杆菌属(Methanobacterium)、甲烷囊菌属(Methanoculleus)和甲烷硫酸盐还原菌属(Methanosarcina))表现出较强的共现关系,表明这些微生物是mVOCs的关键生产者。因此,mVOCs有望作为AD性能的生化指标,有助于阐明mVOCs的产生机制以及贡献微生物的种类。未来研究需进一步解析mVOCs在其他AD过程扰动中的分辨能力,并建立最佳的测量频率和参考值。
引言
在厌氧消化(AD)过程中,过程监测对于确保其稳定性和效率至关重要,这依赖于可靠且灵敏的早期预警指标(EWI)的使用。目前,传统的早期预警指标选项包括pH值、挥发性脂肪酸(VFAs)、电导率(EC)、氧化还原电位(ORP)、碱度以及氨氮。然而,对于哪一种单独或联合使用的指标最能有效识别AD过程的微生物状态,目前仍缺乏共识。此外,尽管一些创新性指标已在实验室规模或中试系统中成功应用,例如紫外-可见光谱和荧光光谱、近红外光谱、光学比色传感器以及中红外光谱,AD过程不稳定的根本原因仍归结于微生物代谢紊乱。但是,上述指标主要强调底物的物理化学特性,往往无法准确反映微生物代谢活性。尽管宏基因组学、宏转录组学和宏蛋白质组学能够为基因和代谢途径提供有价值的见解,但样本预处理、生物信息学分析、序列比对以及结果验证等过程耗时较长,阻碍了对微生物生长状态的及时评估。总体而言,目前严重缺乏能够直接反映实际微生物状态的创新性早期预警指标。
尽管甲烷通常是厌氧系统的主要目标产物,但在厌氧消化过程中也会产生一些副产物,例如微生物挥发性有机化合物(mVOCs),包括醇类、羰基化合物、烃类、芳香族化合物以及含硫和氮的化合物。同时,mVOCs的变化为研究微生物对外界扰动的响应提供了有价值的见解。典型的例子包括mVOCs作为非侵入性诊断工具在动物和人类健康领域的潜力,以及其作为信息化学物质促进细菌抗生素抗性进化的研究。在这些生物系统中,mVOCs表现出物种特异性特征,作为微生物在种内和种间交流的“语言”。此外,mVOCs不溶于水且具有高挥发性,能够更精确、灵敏地反映AD系统中的微生物状态,并且与表型密切相关。这些特性使得mVOCs成为能够最早到达目标生物的化合物。因此,将这一概念应用于直接监测微生物活性以及预测AD过程的不稳定性是合乎逻辑的。
受此启发,mVOCs被认为有望作为预测AD过程不稳定性的早期预警指标。然而,目前尚无关于mVOCs在操作参数扰动下的排放特征数据,尤其是在对多种mVOCs分子进行表征方面。现有研究表明,微生物代谢功能在有机负荷率(OLR)扰动下表现出明显的转变,这种扰动在AD中频繁发生。因此,这种扰动可能不可避免地导致独特mVOCs的排放。因此,研究认为OLR扰动对厌氧微生物群落的影响可能对AD系统的不稳定运行具有重要意义,这种关系可能为解决AD系统频繁出现的不稳定性问题提供机会。
因此,本研究采用GC-Orbitrap/MS结合非靶向分析方法,通过表征多种mVOCs分子,研究不同OLR扰动下mVOCs的组成和丰度变化。主要目标是识别特定的mVOCs,并探索其作为AD系统稳定性指标的潜力。本研究是首次探索mVOCs分子作为AD系统潜在不稳定性的指示物。
研究方法
(1)实验设计:使用来自上海某厨余垃圾处理厌氧消化设施的接种物和原料,设置三个10 L的半连续厌氧消化系统,分别标记为Blank(对照组)、Gradual(逐渐增加OLR)和Pulse(脉冲式增加OLR)。
(2)OLR扰动:在52天启动期后,Gradual组每10天将OLR增加至6.0 gVS·L⁻¹·d⁻¹,Pulse组每5天增加至6.0 gVS·L⁻¹·d⁻¹,从第107天起,两组OLR均增加至9.0 gVS·L⁻¹·d⁻¹。
(3)样品采集与分析:通过GC-Orbitrap/MS技术分析mVOCs的组成和丰度,同时进行16S rRNA基因测序分析微生物群落结构。
主要结果
结果一:有机负荷率(OLR)扰动对厌氧消化(AD)性能的影响
本研究考察了不同OLR扰动模式对厌氧消化性能的影响。在启动阶段(第0~52天),三个反应器的OLR从0.5 gVS·L⁻¹·d⁻¹逐步增加至3.0 gVS·L⁻¹·d⁻¹,甲烷产量均显著上升(图1A)。第53天后,对照组(Blank)维持稳定运行,平均甲烷产量为373.2 ± 58.6 mL·CH₄·gVS⁻¹·d⁻¹,VFAs浓度低于100 mM·L⁻¹(图1B),pH值保持在7.4~7.8(图1E),表现出良好的系统稳定性。
在渐进组(Gradual)反应器中,OLR以每10天为周期逐步增加至6.0 gVS·L⁻¹·d⁻¹,随后在第107天进一步提高至9.0 gVS·L⁻¹·d⁻¹(图1A)。结果显示,甲烷产量在OLR增加至9.0 gVS·L⁻¹·d⁻¹后波动加剧,最终在实验结束时接近完全抑制(<100 mL·CH₄·gVS⁻¹·d⁻¹),同时VFAs浓度显著积累(>200 mM·L⁻¹)(图1B),表明低频率的OLR扰动对系统稳定性造成了较大冲击。
相比之下,脉冲组(Pulse)反应器以每5天为周期增加OLR至6.0 gVS·L⁻¹·d⁻¹,随后在第107天提高至9.0 gVS·L⁻¹·d⁻¹(图1A)。该反应器表现出更显著的甲烷产量波动,但恢复速度更快,且在实验结束时仍保持中等水平的甲烷产量(291.6±82.8 mL·CH₄·gVS⁻¹·d⁻¹)(图1A)。这表明高频率的OLR扰动虽然导致了较大的波动,但系统能够更好地适应,显示出更强的抗冲击能力。

图1. 有机负荷率(OLR)扰动对厌氧消化性能的影响。(A) 不同处理条件下OLR的变化以及甲烷产量的响应;(B) 挥发性脂肪酸(VFAs)浓度变化;(C) 乙酸浓度变化;(D) 丙酸浓度变化;(E) pH值变化。图中各线条的阴影区域表示三次重复测量的标准偏差。
结果二:OLR扰动引起的mVOCs变化特征
在本研究中,对三个反应器的mVOCs分析表明,OLR扰动显著影响了mVOCs的组成和丰度(图2)。mVOCs的变化特征主要分为三类趋势:第一类包括烷烃、烯烃、醇类、醛类、酮类和芳香烃等化合物,这些对OLR扰动表现出较高的敏感性,在Gradual和Pulse反应器中,这些化合物在OLR增加至6.0 gVS·L⁻¹·d⁻¹时显著增加,但在OLR进一步提高至9.0 gVS·L⁻¹·d⁻¹时,其浓度有所下降,这可能与VFAs积累对mVOCs产生的抑制作用有关;第二类如酰胺和醚类化合物,在OLR为9.0 gVS·L⁻¹·d⁻¹时表现出显著差异,并在后续时间点持续变化,表明这些化合物可能与系统对高负荷扰动的长期响应相关;第三类包括部分mVOCs在Gradual和Pulse反应器中与Blank组基本一致,表明其产生菌对OLR扰动具有较高的耐受性。此外,主成分分析(PCA)表明,mVOCs的变化主要受厌氧消化阶段和不同反应器的影响(图3A-B),其中PC1解释了34.9%的方差,主要反映了不同AD阶段mVOCs分布的变化;PC2解释了25.5%的方差,主要捕捉了不同反应器之间的差异(图3B)。这些结果表明,mVOCs的变化与甲烷产量的波动(图1A)以及VFAs浓度的变化(图1B)高度一致,进一步证实了mVOCs作为厌氧消化过程稳定性指标的潜力。

图2. 不同厌氧消化阶段中各类mVOCs的时间演变特征。(A-F) 展示了对OLR扰动敏感的mVOCs(如芳香烃、烷烃、烯烃、醇类、醛类和酮类)的变化趋势; (G-H) 展示了在高OLR条件下(9.0 gVS·L⁻¹·d⁻¹)出现显著差异的mVOCs(如酰胺和醚类)的变化趋势;(I-L) 展示了在OLR扰动下与对照组(Blank)基本一致的mVOCs的变化趋势。图中各线条的阴影区域表示三次重复测量的标准偏差。

图3. OLR扰动对厌氧消化过程中mVOCs的影响。(A) PCA分析显示不同OLR扰动条件下mVOCs的差异。图中每个点代表一个样本,不同颜色代表不同的反应器(Blank、Gradual、Pulse),箭头表示主成分分析的方向。(B) 在主成分1(PC1)和主成分2(PC2)中差异显著的mVOCs。图中显示了对mVOCs分布变化贡献最大的化合物。(C) 火山图分析显示Blank与Gradual反应器之间差异显著的mVOCs(FC > 1 或 < 1,VIP > 1,p < 0.05)。(D) 火山图分析显示Blank与Pulse反应器之间差异显著的mVOCs(FC > 1 或 < 1,VIP > 1,p < 0.05)。图中各点的大小和颜色表示mVOCs的差异倍数和显著性水平。
结果三:OLR扰动对微生物群落结构的影响
本研究通过16S rRNA基因测序分析了不同OLR扰动条件下微生物群落的动态变化(图4)。结果显示,细菌群落主要由放线菌属(Actinomyces)、互营乙酸菌属(Syntrophaceticus)、角蛋白菌属(Keratinibaculum)、蛋白菌属(Proteiniphilum)、脱流热袍菌属(Defluviitoga)和苛求丝菌属(Fastidiosipila)组成,而古菌群落则以甲烷囊菌属(Methanoculleus)、甲烷杆菌属(Methanobacterium)、甲烷硫酸盐还原菌属(Methanosarcina)和甲烷短杆菌属(Methanobrevibacter)为主。在OLR扰动前,Gradual和Pulse反应器的微生物群落与Blank反应器相似,但在OLR扰动后,Gradual和Pulse反应器的微生物群落结构发生显著变化,表现为互营乙酸菌属(Syntrophaceticus)相对丰度增加,而放线菌属(Actinomyces)在Blank反应器中占主导地位。此外,古菌群落中甲烷囊菌属(Methanoculleus)的相对丰度在高OLR条件下显著上升,表明其对OLR扰动具有较高的适应性(图4A)。非度量多维标度分析(NMDS)进一步揭示了微生物群落随时间的演变以及不同反应器之间的差异(图4B和4C)。整体而言,OLR扰动显著改变了微生物群落的α多样性和β多样性,其中Pulse反应器的α多样性最低,表明频繁的OLR扰动降低了微生物群落的均匀性(图5)。这些结果表明,OLR扰动通过改变微生物群落结构,进而影响了厌氧消化过程的代谢功能和稳定性。

图4.不同厌氧消化阶段的微生物群落结构变化。(A) 基于16S rRNA基因数据的古菌和细菌在属水平上的组成变化(堆叠柱状图);(B) 细菌群落的非度量多维标度分析(NMDS);(C) 古菌群落的非度量多维标度分析(NMDS)。图中不同颜色代表不同反应器(Blank、Gradual、Pulse),不同时间点的样本用不同形状标记,箭头表示群落结构的变化趋势。
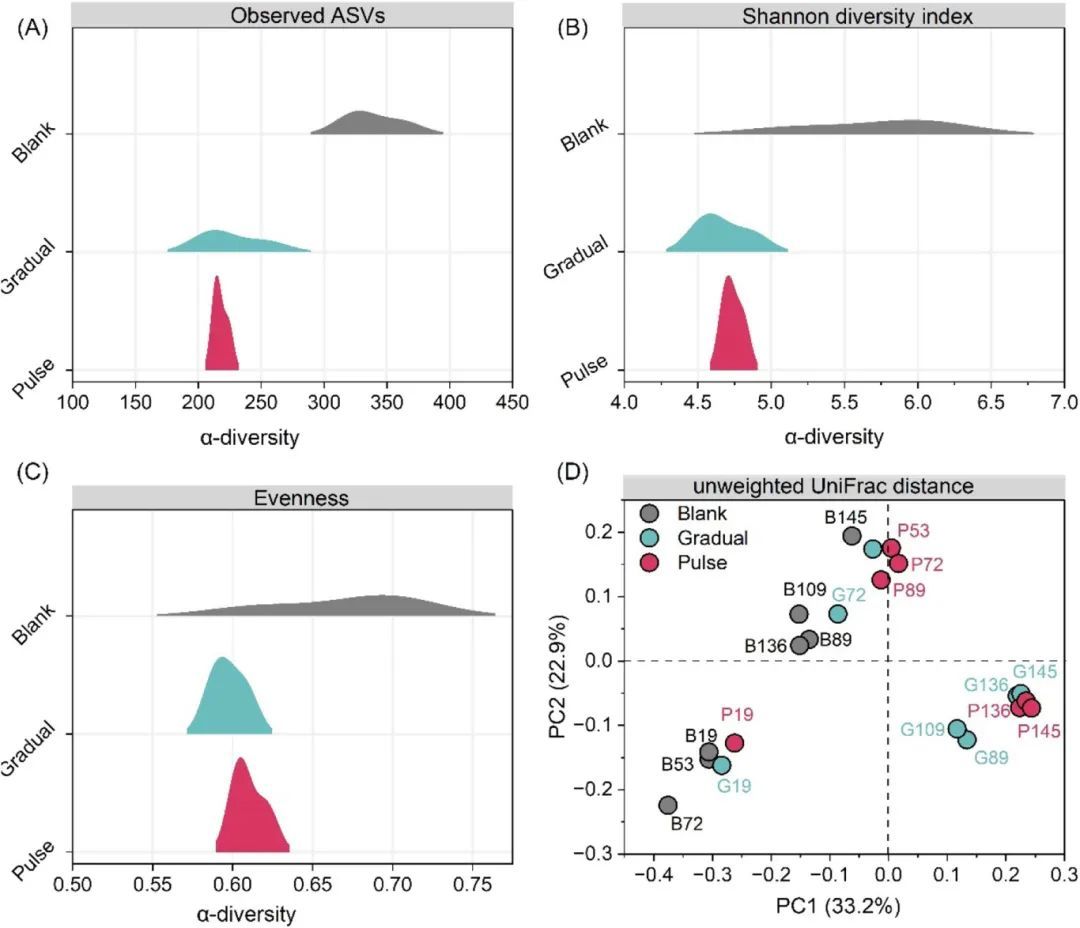
图5.不同OLR扰动条件下微生物群落的α多样性和β多样性分析。(a) 基于扩增子序列变体(ASV)数量的α多样性分析;(b) Shannon多样性指数;(c) 群落均匀度(Evenness);(d) 基于加权UniFrac距离的主坐标分析(PCoA),用于评估不同发酵阶段微生物群落的β多样性。图中不同颜色代表不同反应器(Blank、Gradual、Pulse),误差条表示三次重复的标准偏差。
结果四:微生物群落与OLR扰动响应相关的mVOCs
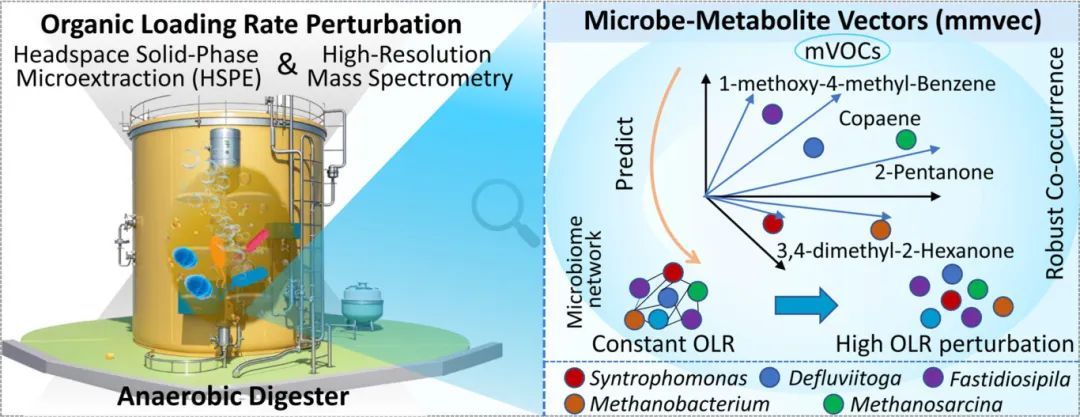
本研究通过微生物-代谢物共现网络分析(图6),揭示了微生物群落与mVOCs之间的潜在关联。结果表明,特定细菌属(如放线菌属(Actinomyces)、互营乙酸菌属(Syntrophaceticus)、角蛋白菌属(Keratinibaculum)、蛋白菌属(Proteiniphilum)、脱流热袍菌属(Defluviitoga)和苛求丝菌属(Fastidiosipila))与多种mVOCs(如苯甲醚、2-己酮、单萜类化合物等)表现出显著的共现关系。此外,古菌属(如甲烷杆菌属(Methanobacterium)、甲烷囊菌属(Methanoculleus)和甲烷硫酸盐还原菌属(Methanosarcina))也与某些mVOCs(如花生四烯酰血清素和氨基蝶呤)具有较高的共现概率。这些结果表明,OLR扰动下微生物群落结构的变化可能通过影响关键微生物的代谢活动,进而驱动mVOCs的产生和变化。因此,mVOCs可作为反映微生物群落状态及其对OLR扰动响应的潜在指标。

图6. 基于微生物-代谢物共现分析(Mmvec)的mVOCs与微生物群落的关联网络图。图中点代表mVOCs,点之间的距离表示它们的共现强度;箭头代表微生物属,箭头之间的夹角越小,表明微生物属之间的共现关系越强。点和箭头的排列揭示了微生物与mVOCs之间的共现关系。
总结
本研究基于微生物挥发性有机化合物(mVOCs)的分子动态变化特征,建立了一种针对厌氧消化(AD)过程不稳定性的有效早期预警策略。研究发现,无论是逐渐增加还是脉冲式增加有机负荷率(OLR),均会导致甲烷产量的降低和挥发性脂肪酸(VFAs)浓度的升高,表明系统可能出现潜在的运行故障。从代谢物角度来看,这些变化与mVOCs的波动高度一致。
研究识别出与AD过程稳定性密切相关的mVOCs类别,包括烷烃、烯烃、醇类、醛类、酮类和芳香烃。此外,OLR扰动还导致细菌和古菌群落结构的显著变化,这些变化在16S rRNA基因水平上清晰可见。通过整合微生物和代谢物分析,研究发现mVOCs与特定细菌属(如互营单胞菌属(Syntrophomonas)、脱流热袍菌属(Defluviitoga)和苛求丝菌属(Fastidiosipila))以及古菌属(如甲烷杆菌属(Methanobacterium)、甲烷囊菌属(Methanoculleus)和甲烷硫酸盐还原菌属(Methanosarcina))表现出强烈的共现关系,表明这些微生物是mVOCs的关键生产者。
本研究为探索mVOCs作为监测工具和AD过程早期预警指标的潜力奠定了基础框架。未来研究需进一步揭示mVOCs在AD系统中的生理功能,并确认特定微生物群落与特定mVOCs之间的联系。此外,还需探索mVOCs对不同扰动和底物的响应能力,并确定评估微生物过程稳定性的最佳测量频率和参考值。
原文转载自:《【文献精读121】厌氧消化过程中产生的微生物挥发性有机化合物可作为微生物群落稳定性的潜在指标》byNENU微研
原文链接:https://mp.weixin.qq.com/s/eU1AOl5pTvSg3cpA9ezzQg